Afhankelijk van de kijkhoek: we kunnen niets meer waarnemen dan een artefact van het meten van antilichamen.
Als we aannemen dat niet alle patiënten antilichamen vormen met dezelfde incidentie, maar alle patiënten met dezelfde waarschijnlijkheid en één en dezelfde patiënt met een constante snelheid, dan kan een vrij eenvoudig effect van immunogeniciteit worden waargenomen:
bij constante toediening worden antilichamen gewoon met een constante snelheid opgebruikt, actief en gebonden, maar niet vrij en meetbaar. Bij episodische behandeling leidt de snelheid van antilichaamproductie tot meer vrije antilichamen (niet opgebruikt) om te meten - en onmiddellijk beschikbaar voor actie tegen het biologische, zodra dat opnieuw in het systeem is geïntroduceerd.
Dus een een eenvoudige herformulering van het inleidende citaat uit de vraag zou kunnen lezen
Onderbreking van geplande onderhoudsbehandeling met anti-TNF-therapie of episodische therapie is consequent in verband gebracht met hogere percentages van antilichaam vorming detectie .
Een recent artikel vat de situatie samen als:
Behandelingsopties omvatten biologische therapieën; een deel van de patiënten verliest echter de respons op biologische geneesmiddelen, deels als gevolg van de vorming van antilichamen tegen geneesmiddelen (ADAbs). Gelijktijdige immunosuppressiva verminderen de ontwikkeling van ADAbs.
Er is een uitgebreid literatuuronderzoek uitgevoerd naar artikelen die van januari 2009 tot augustus 2015 zijn gepubliceerd en waarin immunogeniteit voor adalimumab (ADM), certolizumab pegol (CZP), golimumab, infliximab (IFX) wordt gerapporteerd , ustekinumab en vedolizumab bij inflammatoire darmaandoeningen (IBD).
In de meeste van de opgenomen onderzoeken waarin de werkzaamheid werd geëvalueerd, werd de aanwezigheid van ADAbs in verband gebracht met een vermindering van de werkzaamheid. De werkzaamheid werd op verschillende manieren beoordeeld, waaronder de respons / remissie van de ziekte van Crohn (CDAI), Mayo-respons, endoscopische verbetering en stopzetting van de behandeling. In onderzoeken met IFX was het aantal patiënten dat een respons bereikte en handhaafde over het algemeen lager voor patiënten met gedetecteerde ADAbs dan voor patiënten zonder gedetecteerde ADAbs (aanvullende tabel 7). ADAbs tegen ADM werden ook in verband gebracht met een verminderde werkzaamheid en een verlies van respons, samen met een hoog percentage mislukte secundaire behandelingen; deze associaties bleken in sommige onderzoeken statistisch significant te zijn (aanvullende tabel 8). In één onderzoek werd gemeld dat het staken van de ADM-behandeling 26 zeer hoog was (83,3%) bij patiënten met ADAbs (aanvullende tabel 8).
De timing van de bemonstering (vóór of net na de volgende toediening) heeft een grote invloed op het opsporingspercentage. De meeste assays detecteren geen ADAbs in aanwezigheid van een geneesmiddel; aangezien de geneesmiddelconcentratie het laagst is vlak voor de volgende infusie, is dit de optimale tijd om te bemonsteren. Dit zou een verklaring kunnen zijn voor het feit dat de vorming van ADAbs lager is in RCT's dan in observationele studies. Vaak werd een beperkt aantal tijdstippen bestudeerd en werd er onvoldoende tijd gelaten om de medicijnniveaus te laten dalen voorafgaand aan het nemen van monsters . Het is echter ook waarschijnlijk dat verbeterde assaytechnieken die in observationele studies werden gebruikt, samen met de selectie van patiënten met een verminderde respons, leidden tot hogere detectieniveaus van ADAbs dan in RCT's.
Séverine Vermeire & Ann Gils & Paola Accossato & Sadiq Lula & Amy Marren: "Immunogeniciteit van biologische geneesmiddelen bij inflammatoire darmaandoeningen", Therap Adv Gastro-enterol. 2018; 11: 1756283X17750355. Online gepubliceerd op 21 januari 2018. Doi: 10.1177 / 1756283X17750355, PMCID: PMC5784568, PMID: 29383030.
De hierboven is echter slechts hopelijk geïnformeerde speculatie, gebaseerd op het gebrek aan informatie in de bestudeerde artikelen over hoe antilichamen werden gemeten. Dat is of al deze mogelijke waarden werden genomen: antigeenconcentratie, de antigeen-antilichaamcomplexconcentratie, de vrije antilichaam- en / of totale antilichaamconcentraties.
De antigeen-antilichaamreactie wordt veel gebruikt in laboratoriumdiagnostiek, waaronder immunohematologie. Het is een omkeerbare chemische reactie:
antigeen + antilichaam ⇄ antigeen - antilichaamcomplex
De krachten die het antigeen-antilichaamcomplex verbinden, zijn geen sterke covalente bindingen maar zwakkere bindingen, toepasselijk 'zwakke bindingen' genoemd. interacties ”.
Roberto Reverberi & Lorenzo Reverberi:" Factoren die de antigeen-antilichaamreactie beïnvloeden ", Blood Transfus. 2007 okt; 5 (4): 227-240. doi: 10.2450 / 2007.0047-07 PMCID: PMC2581910, PMID: 19204779
Op jacht naar een wilde gans : Nog speculatiever zou de gedachte kunnen zijn dat in deze processen een effect van continue versterking versus intermitterende versterking optreedt.
Een punt om op te merken: Infliximab is heel anders dan andere anti-TNF-middelen, aangezien ze verschillen behoorlijk van elkaar in hun eigenschappen:
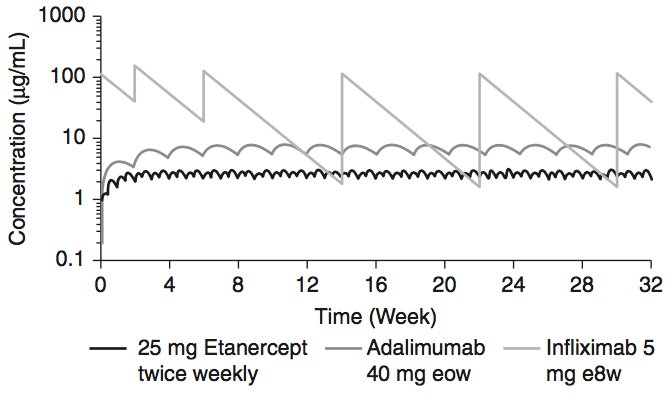
Een farmacokinetische simulatie van serumconcentraties van infliximab, etanercept en adalimumab in steady state bij patiënten met RA die met elk geneesmiddel worden behandeld in de weergegeven doses en schema's.
Klinische gevolgen van immunogeniciteit van TNF-antagonisten omvatten verworven geneesmiddelresistentie en reacties op de infusie- of injectieplaats. Antilichamen tegen geneesmiddelen kunnen multivalente complexen vormen met het doelgeneesmiddel, wat leidt tot een snelle klaring en inactivering van het geneesmiddel. Strategieën om hiermee om te gaan zijn onder meer dosisverhoging of de toevoeging van gelijktijdige immunosuppressieve therapie om de vorming van antilichamen te verminderen. Onderzoek naar de immunogeniteit van op proteïne gebaseerde geneesmiddelen heeft gesuggereerd dat chimere antilichamen in het algemeen meer immunogeen zijn dan gehumaniseerde of menselijke antilichamen. Vergelijkingen van het immunogene potentieel van de anti-TNF-middelen zijn echter moeilijk, grotendeels vanwege verschillen in de gevoeligheid van de testen die zijn ontworpen om antilichamen tegen geneesmiddelen te detecteren, evenals de interferentie in de testen van het geneesmiddel zelf.
Jennifer L. Jones: "Zijn alle anti-TNF-middelen hetzelfde?", in: Peter M. Irving et al (Eds): "Clinical Dilemmas in Inflammatory Bowel Disease", Wiley-Blackwell: Chichester, Hobokem 2 2011.